Es una ruta que tiene lugar en el citosol y cuyo
sustrato inicial principal es la glucosa aunque también se metabolizan a través
de ella otros azúcares como otras hexosas y triosas.
En 10 pasos o reacciones, transforma 1 molécula
de piruvato, generando en el proceso 2 moléculas de ATP.
En el conjunto de la ruta puede
dividirse en 2 fases distintas: una primera fase de inversión de energía que
comprende las 5 primeras reacciones, y una segunda fase de generación de
energía, que comprende a las 5 últimas reacciones.
La primera fase, la de inversión de energía,
rompe el carbono y la segunda, consigue energía
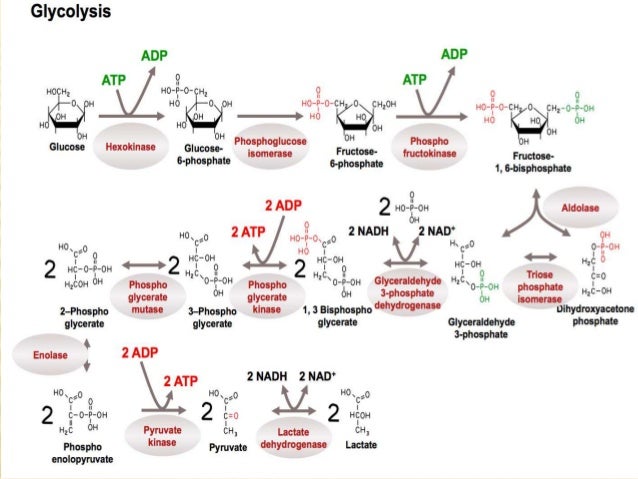
Primera fase
de inversión de energía:
1.
Hexoquinasa: enzima que transforma
glucosa en glucosa-6-P. Las enzimas que requieren ATP necesitan Mg2+ ya que se
acompleja con el ATP. La hexoquinasa posee una amplia especificidad por hexosas
(manosa y fructosa) aunque su mayor afinidad la presenta por la glucosa (Km de
0.01-0.1 mM)
El control es por una competición por el sustrato.
Actúa a concentraciones cercanas a la saturación
(concentraciones intracelulares de glucosa son elevadas).
El hígado posee una isoforma de la hexoquinasa
estándar, la Glucoquinasa.
La Glucoquinasa posee una Km para la glucosa
elevada (10mM) con respecto a la Hexoquinasa aunque no posee afinidad por otros
azúcares. Además, no se inhibe por su producto, la glucosa 6-P. Está destinada
al almacenamiento de glucosa en el hígado en forma de glucógeno.
*Isoenzima: distintas enzimas que catalizan la
misma reacción pero que tiene pequeños detalles que las diferencian, como la
afinidad, como se regula... Están codificadas en el genoma por genes distintos.
2. Segunda reacción: fosfoglucoisomerasa. Tienen una relación de
tautomería.
Si se cortase una molécula como la glucosa
(hexosa), es más complicado por lo que la isomerizas para así dejar libre el
carbono 1. Así además se puede cortar entre el carbono 3 y 4.
3.
Tercera reacción: fosfofructoquinasa
·
Bis-fosfato: dos fosfatos unidos a
dos puntos diferentes.
Di-fosfato: dos fosfatos unidos entre sí y a la molécula.
Se consume el 2º ATP y es el punto más importante
de control de la ruta.
Es una enzima alostérica sensible a
la situación energética de la célula y a las concentraciones de metabolitos
intermediarios de otras rutas como el citrato o los ácidos grasos.
4. Cuarta reacción: Fructosa-1,6-bifosfato aldolasa o aldolasa.
El AG es muy positivo, por lo que en condiciones
estándar debería ir en sentido fisiológico. No es lo mismo las condiciones
estándar como las condiciones reales y al ver poco producto, empuja la reacción
hacia la derecha. La glucólisis funciona próxima al equilibrio.
5. Quinta reacción: Triosa fosfato isomerasa.
Se vuelve a isomerizar, una tautomería. Esto se
debe a que la fase siguiente transcurre con G3P dado que la otra no puede
usarse en las siguientes reacciones, sino, se perderían 3 carbonos.
Segunda fase
de generación de energía
6. Gliceraldehido-3-fosfato deshidrogenasa.
Las deshidrogenasas quitan átomos de hidrógeno
oxidando así a las moléculas.
Se genera el primer intermediario de
elevada energía y un par de equivalentes reductores.
Tiene lugar una oxidación del C
carbonílico a C carboxílico. Esta oxidación es un proceso exergónico de tal
manera que la energía que se libere en la reacción se aprovechará para generar
el intermediario de elevada energía, un compuesto con un enlace ácido carboxilico‐fosfato
o acil‐fosfato
El mecanismo de catálisis se basa en
la formación de un enlace tiohemiacetal entre el C carbonílico y una Cys del centro
activo de la enzima.
Tras la formación de un tiohemiacetal,
éste se oxida hasta formar un tioéster, un enlace de alta energía.
*Intermediario tiohemiacetal:
Sustituido un oxígeno por azufre.
Un enlace fosfato o un tioester, son
enlaces de alta energía y forman así intermediarios de alta energía.
Se tiene que liberar la molécula del
bolsillo catalítico, para ello se utiliza el ataque nucleofílico y se rompe el
enlace con el azufre y se une con un O de un fosfato. No se utiliza una
molécula de agua porque entonces perdería su condición de intermediario de alta
energía. Esto es una fosforólisis.
Así la enzima lo que hace es
catalizar una fosforólisis.
La fosforólisis del tioéster por un
Pi consigue preservar la energía del enlace en forma de acil‐ fosfato.

7. Fosfoglicerato quinasa:
La energía de hidrólisis del 1,
3‐bisfosfoglicerato conduce el primer paso de fosforilación a nivel de
sustrato.
En condiciones reales, la enzima
funciona próxima al equilibrio.
Ahora ya el balance neto de ATP es 0,
los dos que perdíamos los hemos recuperado.
8. Fosfoglicerato mutasa:
9. Enolasa
Transforma el 3-fosfoglicerato en fosfoenolglicerato.
Es otra enzima que funciona próxima al equilibrio.
El enlace O-PO3 2- es un enlace de
alta energía porque sin el PO3 2- es un enol y éstos termodinámicamente tienden
a la forma cetónica y eso termodinámicamente forma inestabilidad al impedírselo
el PO3 2-.
10. Piruvato quinasa.
Segunda fosforilación a sustrato.
La piruvato quinasa
supone otro de los puntos
importantes de regulación de la ruta.
La enzima hepática posee regulación alostérica, de manera que se inhibe
en presencia de niveles elevados de ATP y se activa en presencia de fructosa-‐1,6-‐bisfofato.
Las
concentraciones de piruvato
quinasa hepática se controla
de manera genética.
La actividad
de la enzima hepática también se regula por fosforilación/desfoforilación. La enzima desfosforilada es activa, mientras
que la versión fosforilada es inactiva.
En respuesta
a señales hormonales (y cuando los ácidos grasos y el ácido cítrico
han cubierto las necesidades energéticas de la célula), se fosforila
la enzima con lo que el
fosfoenolpiruvato se deriva
hacia la gluconeogénesis.
En cambio, en el músculo la isoforma correspondiente de la piruvato quinasa es insensible a este último mecanismo de regulación. Casi todo el fosfoenolpiruvato se transforma a piruvato.
Muy bueno, me ayudado mucho, gracias
ResponderEliminar